大阪大学免疫学フロンティア研究センター 免疫ネットワーク研究室 English
研究research
研究プロジェクト
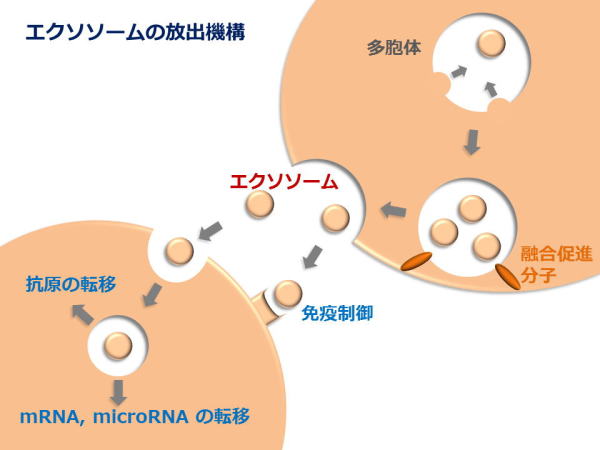
1) 分泌膜小胞エクソソームの生理作用と放出機構
私達の体の中では、約60兆もの細胞が互いに連絡を取り合い、情報を交換し合うことで私達の生命活動を支えています。このような細胞間の情報伝達機構はこれまで、表面蛋白質を介した細胞間結合による伝達機構や、サイトカインなどの分泌蛋白質を介した伝達機構が活発に研究されてきました。ところが最近、マクロファージや樹状細胞などの免疫細胞や癌細胞をはじめ、多くの細胞がエクソソーム(exosome)と呼ばれる直径30-100nmの小型膜小胞を放出することにより、遠く離れた細胞まで情報を伝達している可能性が注目を集めつつあります。エクソソームは脂質二重膜で囲まれた膜小胞で、分泌細胞由来の膜蛋白質と細胞質成分で構成されています。エクソソームは、多胞性エンドソーム(multi-vesicular
endosome)と呼ばれる細胞内小胞の中で産生され、多胞性エンドソームが細胞膜と融合することにより細胞外に放出されます。興味深いことに、HIVなどのレトロウイルスやヘルペスウイルスなどは多胞性エンドソームの中で出芽し、エクソソームの放出経路を利用して宿主細胞から放出される事が明らかになっています。また、アルツハイマー病やパーキンソン病、プリオン病を引き起こす蛋白質が、エクソソームによって細胞外へ放出される事が明らかとなり、エクソソームの放出機構は、これらの疾患の病態発生に深く関与する可能性が示されています。
私達はこれまで、エクソソームがどのような分子機構により標的細胞や食細胞に取り込まれるのかを明らかにしてきましたが、エクソソームの生理的機能や意義は未だにほとんど解明されていません。一部でエクソソームは、不要な細胞内成分を外に放出する為の機構と考えられてきましたが、近年、エクソソームは分泌細胞とその標的細胞の間で蛋白質や脂質を交換する重要なメッセンジャーであることが明らかとなりつつあります。特に、エクソソームには生体内抗原や、抗原ペプチド/MHC複合体が含まれていることが示され、免疫細胞間での抗原情報の交換や、免疫細胞の活性化・不活性化など様々な免疫応答を制御する可能性が示されています。更に、エクソソームの内側には、分泌細胞由来のmRNAやmicroRNAが存在することが明らかとなり、細胞間の遺伝情報伝達や癌細胞による免疫系の制御に関与する可能性が示唆されています。
しかし、これらの実験では培養細胞上清から精製し濃縮されたエクソソームが用いられており、このような現象が生体内で本当に起きているのかは未だに分かっていません。エクソソームの生理作用を明らかにする唯一の方法は、エクソソームの放出機構を明らかにし、それを亢進または阻害することによって、どのような生理現象が引き起こされるのかを解明することです。そこで私達の研究室では、次の3つの基本課題を明らかにすることを目標としています。
(1) エクソソームはどのような分子機構で放出されるのか?
(2) エクソソームの生理的機能は何なのか?
(3) エクソソームはどのように生体内で運ばれているのか?
私達は、分子生物学、遺伝子改変マウス、二光子励起顕微鏡などを用いて免疫ネットワークを担うエクソソームの生理的機能と生体内動態を明らかにしたいと考えています。特に、エクソソームを介した免疫制御機構やパーキンソン病などの神経変性疾患の発症機構、更にウイルスの放出機構を解明し、これらの疾患の治療に役立てることを目標にしています。
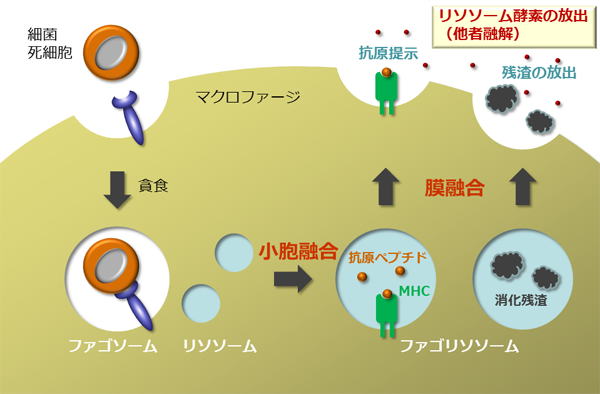
2) マクロファージによるリソソームの開口放出機構
マクロファージは炎症の発症に中心的な役割を担う細胞です。動脈硬化などの慢性疾患や病原体の感染により活性化したマクロファージは炎症性サイトカインなどの生理活性物質を放出し炎症を惹起します。この過程でマクロファージは多くの死細胞や細菌を貪食しリソソーム内で融解しますが、リソソームの一部は分泌型リソソームとして細胞膜と融合しリソソーム内の残渣をリソソーム酵素とともに周囲に開口放出します。リソソーム酵素の放出は未除去の細菌や死にかけの細胞を融解して死滅させる一方、放出が過剰になると健全な細胞をも融解し壊死させ蛋白質の分解を引き起こします。その結果、更なる炎症を惹起すると考えられます。この現象は他者融解(heterolysis)と呼ばれていますが、この過程を制御する分子機構はこれまで明らかになっていません。そこで私達は、マクロファージによるリソソームの開口放出の分子機構を包括的に同定するとともに、生体内でこの現象を可視化することにより、炎症性疾患との因果関係を明らかにすることを目標にしています。
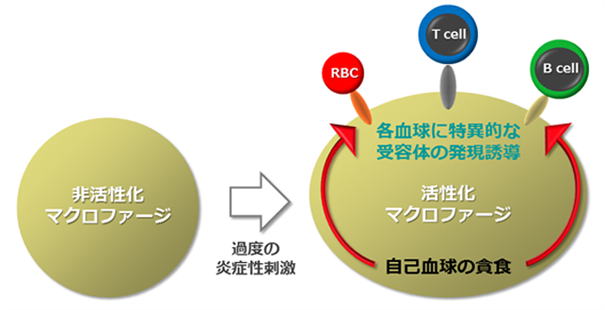
3) 血球貪食症候群の発症機構
私達はこれまで、マクロファージがアポトーシス細胞の表面に露出されるリン脂質ホスファチジルセリンと特異的に結合することにより、アポトーシス細胞の貪食を促進することを示してきました。ところが、ウイルス感染や自己免疫疾患・悪性腫瘍などにより生体内で重篤な炎症反応が生じると、マクロファージが暴走し自己の血球を生きたまま貪食する「血球貪食症候群」が引き起こされます。この疾患は極めて重篤な致死的疾患ですが、その分子機構はほとんど解明されていません。そこで私達は、マクロファージに様々な炎症性刺激を与えることにより、マクロファージによる血球貪食をin
vitroで再構築し、貪食効率を定量化できる実験系を樹立しました。次にこの系を用いて、炎症性刺激でマクロファージに誘導される貪食関連分子のスクリーニングを行い、血球貪食を促進する受容体の1つを最近同定しました。この受容体の阻害により、血球貪食症候群の治療法の開発が将来可能になると期待しております。
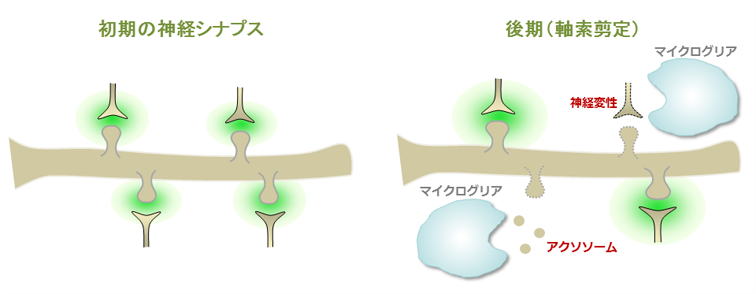
4) マイクログリアによる神経シナプス除去の分子機構
脳神経発達過程の初期において神経シナプスは必要以上に形成されますが、後期には重要なシナプスのみが維持され、それ以外のシナプスは除去されます。シナプス除去には、神経細胞の細胞死と、神経細胞の軸索のみが変性し除去される軸索剪定の2つの機構が存在します。死滅した神経細胞は、マイクログリアに貪食され除去されますが、軸索剪定により変性した軸索もアクソソーム
(axosome) と呼ばれる小胞に分断化された後、マイクログリアに貪食され除去されます。そこで私達は、シナプス除去により生じた死細胞とアクソソームがどのような分子機構を介してマイクログリアに認識され貪食されるのかを明らかにすることを目標にしています。更に、この貪食機構を脳内で阻害する事により、除去されなかった死細胞やアクソソームが、脳内で炎症を惹起して多発性硬化症や神経変性疾患などを誘発するかを最先端のMRIを用いて明らかにすることを目指しています。
これまでの研究成果
1)マクロファージによる死細胞の除去機構とその疾患
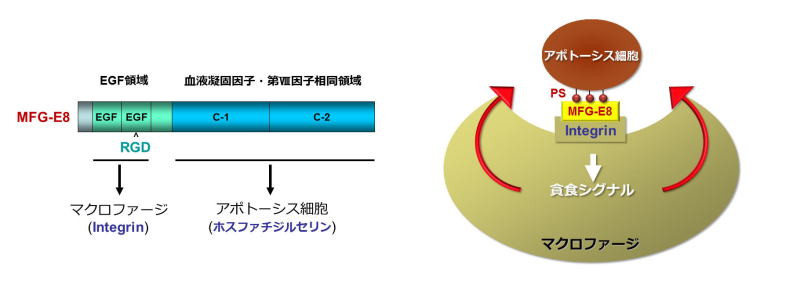
不要になった細胞や有害となる細胞はアポトーシスとよばれる機構により死滅します。私達の体の中では1日に数千億もの細胞がアポトーシスにより死滅し、新しい細胞に置き換わります。生体内でアポトーシスを起こした細胞はマクロファージなどの食細胞に速やかに貪食され除去されます。私達は、この過程に関わる分子機構を明らかにする為、マクロファージによるアポトーシス細胞の貪食を定量化する実験系を樹立しました。次に、マクロファージ表面蛋白質に対するモノクローナル抗体を約3千種類作製し、これらの抗体をそれぞれ貪食の実験系に加えたところ、一つの抗体が貪食に影響を与えることを見いだしました。そこで、この抗体によって認識される蛋白質を精製し同定したところ、MFG-E8と呼ばれる蛋白質でありました。MFG-E8はC末端側のC1,
C2 領域を介して、アポトーシス細胞の細胞膜表面に露出されるリン脂質ホスファチジルセリン(PS)と特異的に結合することが分かりました。さらに、MFG-E8はN末端側のRGD配列を介してマクロファージ上のインテグリンとも結合し、マクロファージによるアポトーシス細胞の貪食を強く促進する分子であることを示しました。
(Nature. 417(6885):182-7, 2002)
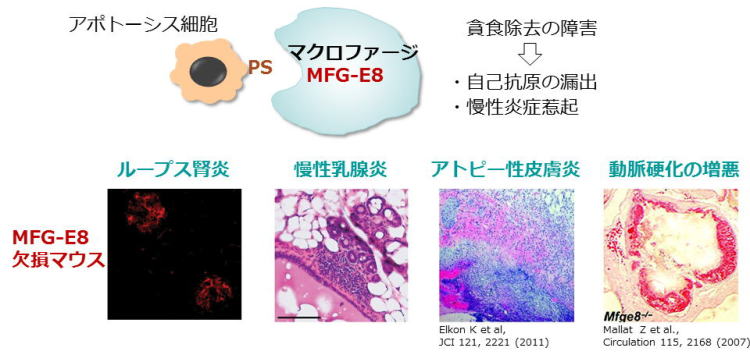
生体内でMFG-E8は、脾臓やリンパ節などの胚中心に存在する胚中心マクロファージに強く発現しています。胚中心では、Bリンパ球が抗原刺激を受け成熟しますが、その多くは活性を持たない抗体を産生する為、アポトーシスにより死滅し胚中心マクロファージに貪食されて除去されます。MFG-E8欠損マウスでは、胚中心マクロファージが死んだBリンパ球を効率良く貪食することができず、マクロファージの細胞外に貪食されなかったアポトーシス細胞が多数留まっていることが分かりました。貪食されなかったアポトーシス細胞の細胞膜には穴が開いてしまう為、細胞内容物が周囲に漏出し、自己抗原として免疫系を活性化します。その結果、MFG-E8欠損マウスは、胚中心の顕著な拡大を伴った脾腫を呈し、抗核抗体、抗二本鎖DNA抗体などの自己抗体を産生する全身性エリテマトーデスに似た自己免疫疾患を発症する事を示しました。
(Science. 304(5674):1147-50, 2004)
更に私達は、授乳期が終わり退縮を始めた乳腺でMFG-E8が強く分泌され、不要になった乳腺上皮細胞を除去していることを見出しました。MFG-E8欠損マウスでは、乳腺上皮細胞の除去だけではなく、乳脂肪球の除去も障害されており、その結果、乳管が著明に拡張した慢性乳腺炎を発症することを示しました。
(PNAS. 102(46):16886-91, 2005)
2)蛋白質の分解異常による神経シナプス除去の発症機構
留学先であるMichael E. Greenberg博士の研究室では、Angelman症候群という小児の精神遅滞の発症機構を研究しました。Angelman症候群は、Ube3Aというユビキチン転移酵素の変異により発症することが知られていましたが、病気の発症原因となるUbe3Aの基質は長らく不明でありました。私は定量的質量分析法を用いた網羅的プロテオーム解析により、その基質の一つがArcと呼ばれる蛋白質であることを突き止めました。さらにAngelman症候群では、神経細胞で分解されずに蓄積したArcが、AMPA型グルタミン酸受容体の細胞表面での発現を阻害する事により、神経シナプスの除去を促進することを明らかにしました。この神経シナプス除去がAngelman症候群の原因である可能性を示しました。
(Cell. 140(5):704-16, 2010)
